Los procedimientos físicos por los cuales se separan las mezclas se denominan métodos de separación.
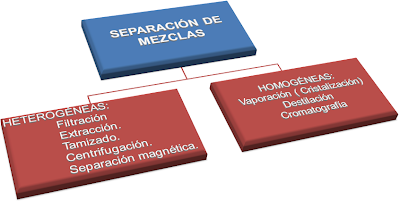
SEPARACION DE LOS COMPONENTES DE MEZCLAS HETEROGÉNEAS
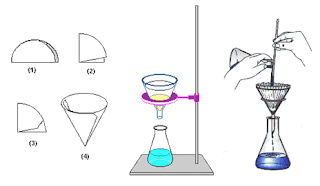
1. FILTRACIÓN: sirve para separar una sustancia sólida no miscible (que no esté disuelta) con una sustancia líquida. Consiste en utilizar un filtro cuyos poros (o agujeros) son más pequeños que el tamaño de las partículas que se quiera separar, de manera que cuando la mezcla se haga pasar a través del filtro éstas quedarán retenidas. Esta técnica se utiliza para separar la nata de la leche, para tamizar la arena en las construcciones, etc. http://www.youtube.com/watch?v=JDxgYTQi4CA

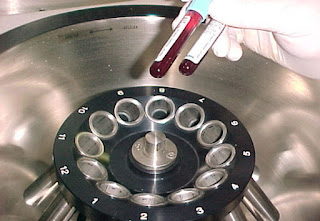
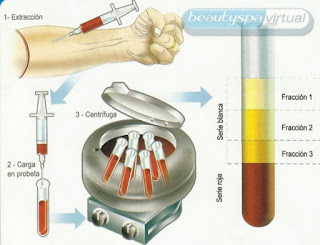
3. CENTRIFUGACIÓN: Sirve para separar, habitualmente, suspensiones de sólidos en líquidos. Consiste en hacer girar la mezcla a una gran velocidad; de esta manera, las partículas más pesadas tienden a “escaparse” de la mezcla, separándose de las restantes. Lógicamente, cuanto mayor sea la masa, con mayor fuerza se separarán las partículas, que quedarán retenidas en el fondo del tubo. Esta técnica se utiliza en los laboratorios de análisis clínicos para separar y estudiar algunas de las sustancias (por ejemplo, los glóbulos rojos) que se encuentran en la sangre. https://www.youtube.com/watch?v=LWZMmCgC5rQ
4. TAMIZADO:
Es el método indicado para separar los componentes de una mezcla de
sólidos según el tamaño de sus partículas. Utilizando el tamiz
apropiado, retendremos en él, el sólido cuyas partículas sean más
gruesas. https://www.youtube.com/watch?v=l5wM7k5MvUM
5. SEPARACIÓN MAGNÉTICA: Sirve para separar una sustancia que forme parte de la mezcla y que posea propiedades magnéticas, es decir, se vea atraída por un imán. Estas sustancias suelen ser metales. Acercando un imán a la mezcla, conseguiremos separar aquellas sustancias que se vean atraídas por él. Esta técnica suele utilizarse en las industrias siderúrgicas para separar los metales del mineral del que proceden.
SEPARACION DE LOS COMPONENTES DE MEZCLAS HOMOGÉNEAS O DISOLUCIONES
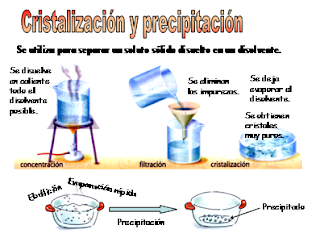
1. CRISTALIZACIÓN: Sirve para separar una sustancia (habitualmente sólida) que se encuentra disuelta en un líquido. Para ello, se utiliza un recipiente muy ancho llamado cristalizador (ver figura a la derecha), en el cual se vierte la disolución; entonces, si se deja evaporar lentamente, el agua va pasando a estado gaseoso y las partículas de la sustancia sólida se unen poco a poco formando cristales con formas geométricas definidas (rombos, polígonos, etc.).
Un ejemplo de cristalización es la separación de la sal del agua del mar en las salinas. La cristalización se puede acelerar aún más mediante el calentamiento a sequedad, que consiste en calentar la disolución en una cápsula de porcelana (ver figura a la izquierda) que se pone en contacto con una fuente de calor (hornillo, mechero,...). En este caso, los cristales de sólido que se obtienen al evaporarse el líquido son de menor tamaño que los que se obtienen a partir de la cristalización.

2. DESTILACIÓN: Sirve para separar una mezcla de dos o más líquidos miscibles entre sí. Para ello, se utiliza un dispositivo como el de la izquierda: se introduce la mezcla de líquidos en el matraz y comienza a calentarse. Entonces, el líquido con menor punto de ebullición comenzará a evaporarse antes que los demás; el agua corre por el tubo refrigerante enfriando dicho vapor, transformándolo en estado líquido (condensación). El líquido termina por caer en el recipiente colector, separándose así del resto de la mezcla. Para que la destilación sea eficaz, los líquidos deben tener puntos de ebullición que se diferencien en, al menos, 10 ºC. http://www.youtube.com/watch?v=cocwhLBtJGg
3. CROMATOGRAFÍA: Es un método físico de separación para la caracterización de mezclas complejas, la cual tiene aplicación en todas las ramas de la ciencia. Es un conjunto de técnicas basadas en el principio de retención selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar y determinar las cantidades de dichos componentes. Diferencias sutiles en el coeficiente de partición de los compuestos da como resultado una retención diferencial sobre la fase estacionaria y por tanto una separación efectiva en función de los tiempos de retención de cada componente de la mezcla.
La cromatografía en papel es un proceso muy utilizado en los laboratorios para realizar análisis cualitativos ya que pese a no ser una técnica muy potente no requiere de ningún tipo de equipamiento.
La cromatografía en papel es un proceso muy utilizado en los laboratorios para realizar análisis cualitativos ya que pese a no ser una técnica muy potente no requiere de ningún tipo de equipamiento.
EXPERIMIENTOS Y VIDEOS EXPLICATIVOS
A continuación voy a dejar unos videos que he recopilado con los distintos métodos de separación de mezclas, en algunos casos con experimientos reales que deberemos replicarlos en clase:1 Filtración de agua casera 2. Decantación
Aquí os dejo una presentación en PDF que nos servirá de resumen de la unidad:
- Resumen de la unidad de la diversidad de la materia.