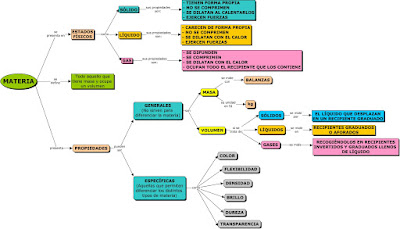
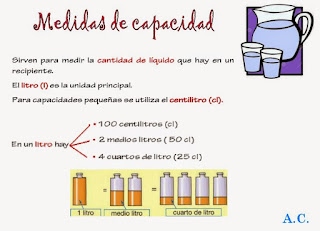
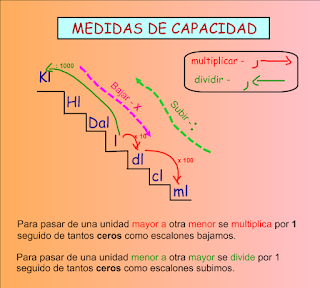
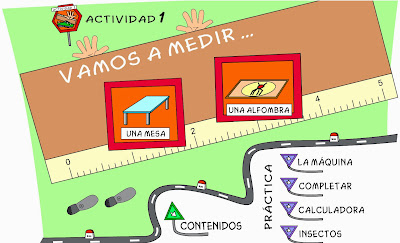
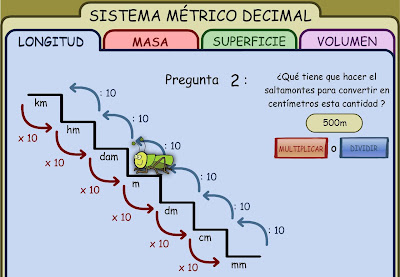
En primer lugar os paso una aplicación donde podemos ver todo el material que nos encontramos en un laboratorio de Química.
Ej.1. Debes verlos todos y anotar en una hoja aquellos que hayas visto ya en el laboratorio de verdad.
Ej.1. Debes verlos todos y anotar en una hoja aquellos que hayas visto ya en el laboratorio de verdad.
Ej.2. Ahora quiero que hagáis las 6 actividades que podemos ver en la parte de arriba a la derecha, la más importante de todas es la 2, que es un práctica de laboratorio virtual. Además debes responder a las siguientes preguntas:
- ¿Cuánto marcaba la temperatura al inicio del experimento?
- Dibuja el trípode utilizado.
- ¿Cómo se mantiene la temperatura cuando el agua es líquida?
- Dibuja el émbolo y el vaso ¿Qué pasa con la temperatura?
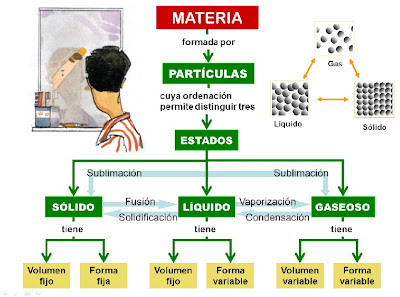
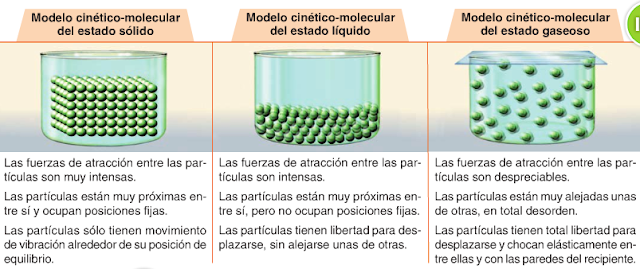
Ej.3. También debéis practicar que pasa con los estados de agregación de la materia y su curva de calentamiento.
Responde a las siguientes cuestiones.
- ¿El Volumen y la temperatura están relacionados entre sí? ¿Exactamente de que manera?
- ¿En qué estado están las moléculas más separadas?
- ¿Cuál es la temperatura de fusión y ebullición del agua? ¿Qué ocurre en ese momento exactamente?
- ¿Qué materiales se han utilizado para hacer el experimento de la derecha?
Ej.4. FINAL (historia con pregunta al final)
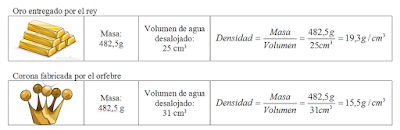
Hierón II, rey de Siracusa en el siglo III a.C. y pariente de Arquímedes, tenía suficiente confianza en él para plantearle problemas aparentemente imposibles. Cierto orfebre le había fabricado una corona de oro. El rey no estaba muy seguro de que el artesano hubiese obrado rectamente; podría haberse guardado parte del oro que le habían entregado y haberlo sustituido por plata o cobre. Así que Hierón encargó a Arquímedes averiguar si la corona era de oro puro [...] .
Arquímedes no sabía qué hacer. El cobre y la plata eran más ligeros que el oro. Si el orfebre hubiese añadido cualquiera de estos metales a la corona, ocuparían un espacio mayor que el de un peso equivalente de oro. Conociendo el espacio ocupado por la corona (es decir, su volumen) podría contestar a Hierón, lo que no sabía era cómo averiguar el volumen de la corona.
 Arquímedes siguió dando vueltas al problema en los baños públicos.[...] De pronto se puso en pie como impulsado por un resorte: se había dado cuenta de que su cuerpo desplazaba agua fuera de la bañera. El volumen de agua desplazado tenía que ser igual al volumen de su cuerpo. Para averiguar el volumen de cualquier cosa bastaba con medir el volumen de agua que desplazaba. [...]
Arquímedes siguió dando vueltas al problema en los baños públicos.[...] De pronto se puso en pie como impulsado por un resorte: se había dado cuenta de que su cuerpo desplazaba agua fuera de la bañera. El volumen de agua desplazado tenía que ser igual al volumen de su cuerpo. Para averiguar el volumen de cualquier cosa bastaba con medir el volumen de agua que desplazaba. [...]
Arquímedes corrió a casa, gritando una y otra vez: "¡Lo encontré, lo encontré!". Llenó de agua un recipiente, metió la corona y midió el volumen de agua desplazada. Luego hizo lo propio con un peso igual de oro puro; el volumen desplazado era menor. El oro de la corona había sido mezclado con un metal más ligero, lo cual le daba un volumen mayor. El rey ordenó ejecutar al orfebre.
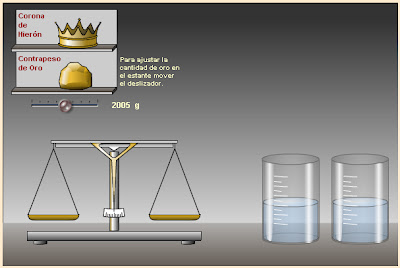
Pincha en la imagen y resuelve al final las preguntas que están formuladas, no tienes que copiar los enunciados sino solamente sus resultados.
Pincha en la imagen y resuelve al final las preguntas que están formuladas, no tienes que copiar los enunciados sino solamente sus resultados.
Ej.5. CASA (para subir nota)
Por último debéis ver el video de Arquímides y los Griegos de la serie "Los Inventores" y hacer un resumen de 50 palabras, con los hechos más importantes.