Tus compañeros, la silla en la que te sientas, o el aire que respiras están formados por materia. La música que oyes, la luz que te permite ver o las ideas que se te ocurren, por el contrario, son inmateriales, no están hechas de materia.
Esta entrada trata de la materia y sus propiedades, los estados de la materia y sus cambios, y el modelo cinético-molecular de la materia. Así mismo seguiremos una serie de apuntes y enlaces de interés que dejaré en la zona de descarga.
 Un perro, los lápices o el pupitre están hechos de materia, pero son totalmente distintos porque están hechos de clases de materia distinta.
Un perro, los lápices o el pupitre están hechos de materia, pero son totalmente distintos porque están hechos de clases de materia distinta.
No toda la materia es igual. Cada clase de materia se llama sustancia y varias materias diferentes forman una mezcla. Una ensalada sería una mezcla (de varias sustancias diferentes). Pero primero veamos qué es la materia y como se calcula y al final veremos su propiedades.
¿Qué es la Materia?
Es todo aquello que tiene masa y ocupa volumen. Así de sencillo, por eso cuando empezamos el tema decíamos que un lápiz, el aire, el humo es materia, pero la música y los sentimientos NO.
Tipos de propiedades de la materia
Propiedades extensivas llamadas también generales, como su nombre lo indica, están basadas en función de la cantidad de materia a considerar, es decir, si nos proponemos a medir una canica de vidrio que tiene una masa de 30 gr, y la comparamos con un cayuco de vidrio también de forma esférica, este último tendrá una masa mucho mayor aunque se trate del mismo material.
Algunos ejemplos de estas propiedades son el peso, volumen, longitud, masa etc., como puedes ver todas ellas dependen de la cantidad de materia a medir
Propiedades intensivas o específicas: son las características de la materia que son independientes de la cantidad a medir, no importa la cantidad pues estas propiedades siempre permanecen constantes, no son aditivas, en muchos casos son el resultado de dos propiedades extensivas, como es el caso de la densidad que es la relación que existe entre masa y volumen, algunas otras propiedades son: Punto de fusión, Punto de ebullición, Densidad, Coeficiente de solubilidad, Indice de refracción entre otros
Para un estudio muy entretenido de estos temas podéis utilizar las siguientes presentaciones que podemos ver a continuación
Esta entrada trata de la materia y sus propiedades, los estados de la materia y sus cambios, y el modelo cinético-molecular de la materia. Así mismo seguiremos una serie de apuntes y enlaces de interés que dejaré en la zona de descarga.
 Un perro, los lápices o el pupitre están hechos de materia, pero son totalmente distintos porque están hechos de clases de materia distinta.
Un perro, los lápices o el pupitre están hechos de materia, pero son totalmente distintos porque están hechos de clases de materia distinta. No toda la materia es igual. Cada clase de materia se llama sustancia y varias materias diferentes forman una mezcla. Una ensalada sería una mezcla (de varias sustancias diferentes). Pero primero veamos qué es la materia y como se calcula y al final veremos su propiedades.
¿Qué es la Materia?
Es todo aquello que tiene masa y ocupa volumen. Así de sencillo, por eso cuando empezamos el tema decíamos que un lápiz, el aire, el humo es materia, pero la música y los sentimientos NO.
Tipos de propiedades de la materia
Algunos ejemplos de estas propiedades son el peso, volumen, longitud, masa etc., como puedes ver todas ellas dependen de la cantidad de materia a medir
Propiedades intensivas o específicas: son las características de la materia que son independientes de la cantidad a medir, no importa la cantidad pues estas propiedades siempre permanecen constantes, no son aditivas, en muchos casos son el resultado de dos propiedades extensivas, como es el caso de la densidad que es la relación que existe entre masa y volumen, algunas otras propiedades son: Punto de fusión, Punto de ebullición, Densidad, Coeficiente de solubilidad, Indice de refracción entre otros
Para un estudio muy entretenido de estos temas podéis utilizar las siguientes presentaciones que podemos ver a continuación
Estados de la materia
La materia puede estar en estado sólido, líquido o gaseoso. Cada una de estas formas de la materia tiene sus propias características y propiedades físicas.
Sólido
- Los sólidos tienen forma definida, esto se puede comprobar ya que aunque los cambiemos de envase o recipiente, mantienen su forma original.
- Ocupan un lugar en el espacio, es decir, tienen volumen definido, por eso dos objetos no pueden ocupar el mismo lugar al mismo tiempo.
- Todos los sólidos, por muy pequeños que sean, tienen materia. La cantidad de materia que tiene un objeto se llama masa y se mide en gramos o kilogramos con un instrumento llamado balanza.
Líquido
- Los líquidos no tienen una forma definida, sino adoptan la forma del envase o recipiente que los contiene.
- Al igual que los sólidos, poseen volumen, es decir, ocupan espacio, por eso no podemos agregar más líquido en un envase o recipiente que ya está lleno.
- Tienen materia, esto se puede comprobar midiendo su masa en una balanza.
Gaseoso
- Al igual que los líquidos, los gases no tienen forma definida, sino que adoptan la forma del recipiente que los contiene.
- Tienen volúmen, es decir, ocupan espacio, sin embargo, a diferencia de los líquidos y sólidos, los gases pueden expandirse en el espacio y pueden ser comprimidos.
- Poseen materia, que es comprobable midiendo su masa en una balanza.
Sólido
|
Líquido
|
Gaseoso
| |
Forma
|
Propia
|
La del recipiente que lo contiene
|
No posee
|
Volumen
|
Constante
|
Constante
|
Ocupa todo el espacio disponible y se expande
|
Fluye
|
No
|
Sí, fácilmente
|
Sí, muy fácilmente
|
Difusión
|
No se difunde
|
Se difunde con relativa facilidad
|
Se difunde con facilidad
|
Compresibilidad
|
No es compresible
|
No es compresible
|
Si es compresible
|
Los siguientes videos muestran los diferentes estados físicos del agua y sus cambios de estado
Y Finalmente dejo una presentación donde está todo lo explicado:
Método Cinético-Molecular
A lo largo de la historia del pensamiento humano se ha elaborado un
modelo acerca de cómo está constituida la materia, se conoce con el
nombre de
MODELO CINÉTICO-MOLECULAR.
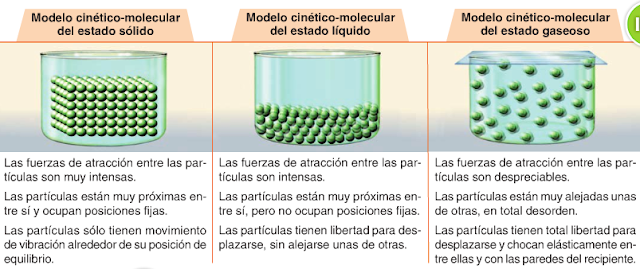
Según este modelo de materia, todo lo que nos rodea está formado por unas partículas muy pequeñas, que son invisibles aún a los mejores microscopios y que se llaman moléculas. Las moléculas están en continuo movimiento y entre ellas existen fuerzas atractivas, llamadas fuerzas de cohesión y fuerzas de repulsión que tienden a dispersar las particulas y a alejarse. Las moléculas, al estar en movimiento, se encuentran a una cierta distancia unas de otras. Entre las moléculas hay espacio vacío. Cuando aumenta la temperatura, las moléculas se mueven más rápido.
 Con este modelo, puede explicarse perfectamente el hecho de que la materia pueda encontrarse en tres estados:
SÓLIDO, LÍQUIDO y GASEOSO. Este modelo permite, también, explicar la razón por la que un sólido puede convertirse en líquido o un gas en líquido, por ejemplo.
Con este modelo, puede explicarse perfectamente el hecho de que la materia pueda encontrarse en tres estados:
SÓLIDO, LÍQUIDO y GASEOSO. Este modelo permite, también, explicar la razón por la que un sólido puede convertirse en líquido o un gas en líquido, por ejemplo.
En el ESTADO SOLIDO las moléculas están muy juntas y se mueven oscilando alrededor de unas posiciones fijas; las fuerzas de cohesión son muy grandes. En el ESTADO LIQUIDO las moléculas están más separadas y se mueven de manera que pueden cambiar sus posiciones, pero las fuerzas de cohesión, aunque son manos intensas que en el estado sólido, impiden que las moléculas puedan independizarse. En el ESTADO GASEOSO las moléculas están totalmente separadas unas de otras y se mueven libremente; no existen fuerzas de cohesión.
Podemos reforzar los contenidos con los siguientes dos videos:
Ahora dejo dos ejercicios con la teoría, con ejemplos y actividades finales:



Actividades
Para concluir esta unidad voy a dejaros una serie de enlaces con actividades que vamos a realizar en el aula Plumier:
1º- Entrar en el siguiente enlace y realizar las actividades:
http://www.iescarrus.com/
Según este modelo de materia, todo lo que nos rodea está formado por unas partículas muy pequeñas, que son invisibles aún a los mejores microscopios y que se llaman moléculas. Las moléculas están en continuo movimiento y entre ellas existen fuerzas atractivas, llamadas fuerzas de cohesión y fuerzas de repulsión que tienden a dispersar las particulas y a alejarse. Las moléculas, al estar en movimiento, se encuentran a una cierta distancia unas de otras. Entre las moléculas hay espacio vacío. Cuando aumenta la temperatura, las moléculas se mueven más rápido.
 Con este modelo, puede explicarse perfectamente el hecho de que la materia pueda encontrarse en tres estados:
SÓLIDO, LÍQUIDO y GASEOSO. Este modelo permite, también, explicar la razón por la que un sólido puede convertirse en líquido o un gas en líquido, por ejemplo.
Con este modelo, puede explicarse perfectamente el hecho de que la materia pueda encontrarse en tres estados:
SÓLIDO, LÍQUIDO y GASEOSO. Este modelo permite, también, explicar la razón por la que un sólido puede convertirse en líquido o un gas en líquido, por ejemplo.En el ESTADO SOLIDO las moléculas están muy juntas y se mueven oscilando alrededor de unas posiciones fijas; las fuerzas de cohesión son muy grandes. En el ESTADO LIQUIDO las moléculas están más separadas y se mueven de manera que pueden cambiar sus posiciones, pero las fuerzas de cohesión, aunque son manos intensas que en el estado sólido, impiden que las moléculas puedan independizarse. En el ESTADO GASEOSO las moléculas están totalmente separadas unas de otras y se mueven libremente; no existen fuerzas de cohesión.
Ahora dejo dos ejercicios con la teoría, con ejemplos y actividades finales:


Actividades
Para concluir esta unidad voy a dejaros una serie de enlaces con actividades que vamos a realizar en el aula Plumier:
1º- Entrar en el siguiente enlace y realizar las actividades:
2º- Aquí pincháis en ejercicios y le dáis una vez a siguiente, debéis hacer la segunda y tercera página:
3º- Realizar la siguiente actividad








0 comentarios:
Publicar un comentario